-
Was ist die DSGVO?
-
Welche Rolle spielt die DSGVO bei klinischen Studien?
-
Verordnung der Europäischen Union zu klinischen Prüfungen
-
Die Wiederherstellung nach Katastrophen im Gesundheitswesen ist unverzichtbar
-
GDPR klinische Studien FAQs
-
Schlussfolgerung
Klinische Studien tragen zur ständigen Verbesserung von Diagnose- und Behandlungsverfahren bei und sind ein unverzichtbarer Bestandteil medizinischen Fortschritts. Eng verbunden mit klinischen Studien sind die Laboruntersuchungen und Tests, die an Patienten durchgeführt werden. Der Prozess beinhaltet den Umgang mit großen Mengen an Gesundheits- und Genetikdaten. Es ist entscheidend, dass klinische Studien den Datenschutzgesetzen entsprechen. Seit der Einführung der DSGVO in europäischen Ländern haben Gesundheitseinrichtungen und Technologieanbieter ihre traditionellen Arbeitsmodelle umfassend überarbeitet, um sicherzustellen, dass ihre medizinischen Leistungen stärker vernetzt und patientenorientierter bleiben.
Was ist die DSGVO?
Die Datenschutz-Grundverordnung (DSGVO) ist eine Verordnung der Europäischen Union, die den Schutz der Privatsphäre und der personenbezogenen Daten von Einzelpersonen innerhalb der EU und des Europäischen Wirtschaftsraums (EWR) sicherstellt. Sie trat am 25. Mai 2018 in Kraft mit dem Ziel, den Einzelpersonen mehr Kontrolle über ihre persönlichen Informationen zu geben und das regulatorische Umfeld für internationale Unternehmen durch die Vereinheitlichung der Datenschutzgesetze in Europa zu vereinfachen. Die DSGVO legt strenge Richtlinien fest, wie Unternehmen personenbezogene Daten erheben, verarbeiten, speichern und übertragen dürfen.
Unter der DSGVO müssen Organisationen die ausdrückliche Einwilligung der Betroffenen einholen, um deren Daten zu verarbeiten, das Recht auf Zugriff, Berichtigung und Löschung der Daten gewährleisten sowie Datenschutzverletzungen innerhalb von 72 Stunden melden. Verstöße gegen die DSGVO können hohe Geldstrafen nach sich ziehen, und zwar bis zu 4 % des weltweiten Jahresumsatzes eines Unternehmens oder 20 Millionen Euro, je nachdem, welcher Betrag höher ist. Die Verordnung legt Wert auf Transparenz, Verantwortlichkeit und Sicherheit und zielt darauf ab, die Privatsphärenrechte der Einzelpersonen zu schützen und gleichzeitig Unternehmen zu ermöglichen, in einer globalen digitalen Wirtschaft zu agieren.
Welche Rolle spielt die DSGVO bei klinischen Studien?
Bei der Verarbeitung von Gesundheitsdaten betrifft die DSGVO besonders sensible Daten. Der Austausch von Gesundheitsdaten zwischen den Mitgliedstaaten hat im öffentlichen Gesundheitswesen zunehmend an Bedeutung gewonnen. Wesentliche Maßnahmen umfassen dabei unter anderem die Bereitstellung medizinischer Versorgung oder Behandlung, die Abwehr schwerer grenzüberschreitender Gesundheitsgefahren sowie die Gewährleistung hoher Qualitätsstandards bei der medizinischen Versorgung und der Qualität und Sicherheit von Arzneimitteln oder Medizingeräten. Die DSGVO legt Regeln fest, um eine rechtliche und vertrauenswürdige Verarbeitung und den Austausch von Gesundheitsdaten innerhalb der EU zu gewährleisten. Sie gilt auch für Dritte, die Zugang zu Patientendaten erhalten – etwa Zusammenfassungen zu Patienten, elektronischen Rezepten oder umfassenden langfristigen elektronischen Gesundheitsakten – sowie für den Einsatz dieser Daten zu wissenschaftlichen Forschungszwecken.
Der grenzüberschreitende Transfer von Daten aus klinischen Studien umfasst mehrere Aspekte wie nationale Gesetze, Vorschriften und den Datenschutz. Beispielsweise wird der grenzüberschreitende Transfer von Daten klinischer Studien in den Vereinigten Staaten durch das Health Insurance Portability and Accountability Act (HIPAA) geschützt, welches darauf abzielt, die Sicherheit und den Schutz von medizinischen Informationen sicherzustellen. HIPAA verlangt, dass beim Transfer ins Ausland ähnliche Datenschutzmaßnahmen für personenbezogene Gesundheitsinformationen gelten wie innerhalb der USA. Die EU hingegen hat die Datenschutz-Grundverordnung (DSGVO) eingeführt, welche auf den grenzüberschreitenden Transfer personenbezogener Daten Anwendung findet, einschließlich Daten aus klinischen Studien. Auch die meisten Nicht-EU-Länder verlangen, dass der Datentransfer durch einen Schutz auf ähnlichem Niveau wie im Inland geschieht.
Im Bereich der DCT (dezentralen klinischen Studien) spielt auch die DSGVO eine Rolle. Elektronische Signaturen werden in DCT-Szenarien zunehmend eingesetzt. Einige Länder/Regionen verlangen bei elektronischen Signaturen die Identitätsprüfung der Teilnehmer über einen Videolink. Je nach Risikoklassifizierung und Interventionsniveau der klinischen Studie können verschiedene Arten elektronischer Signaturen erforderlich sein, und alle elektronischen Einwilligungserklärungen/elektronischen Signaturen müssen den Anforderungen der DSGVO entsprechen. Es ist üblicherweise eine gute Praxis – manchmal sogar erforderlich –, eine Datenschutz-Folgenabschätzung durchzuführen, um die Risiken aus datenschutzrechtlicher Sicht zu bewerten, wenn elektronische Einwilligungserklärungen verwendet werden.
Daher müssen die erhobenen Daten denselben GCP-Standards entsprechen wie jede andere Datenerhebungsmethode. Falls Bedenken bezüglich der Datenqualität bestehen, sollte eine erneute Überwachung in Betracht gezogen werden. Darüber hinaus muss die Verarbeitung aller personenbezogenen Daten im Rahmen der DCT der DSGVO entsprechen.
Verordnung der Europäischen Union zu klinischen Prüfungen
Die Verordnung der Europäischen Union zu klinischen Prüfungen (CTR) ist eine Regelung, die darauf abzielt, den Ablauf klinischer Prüfungen innerhalb der EU zu vereinheitlichen und zu verbessern. Sie wurde eingeführt, um die Sicherheit der Patienten zu erhöhen, die Transparenz zu verbessern und den Genehmigungsprozess für klinische Studien zu vereinfachen, was insbesondere im Zusammenhang mit dem schnellen Wandel im Bereich der medizinischen Forschung von großer Bedeutung ist. Die Verordnung trat am 31. Januar 2022 in Kraft und ersetzte damit die bisherige Richtlinie zu klinischen Prüfungen.
Die CTR führt ein zentrales, EU-weites Einreichungssystem für klinische Prüfungen ein, das den Genehmigungsprozess vereinfacht und die administrativen Belastungen für Sponsoren verringert. Sie schreibt außerdem eine höhere Transparenz vor, wobei die Ergebnisse klinischer Studien über das EU-Register klinischer Studien öffentlich zugänglich gemacht werden müssen. Die Verordnung gewährleistet stärkere Schutzmaßnahmen für die Teilnehmer an klinischen Prüfungen, einschließlich strengerer Informations- und Einwilligungsverfahren sowie einer effektiveren Überwachung des Studienfortschritts. Zudem erleichtert sie die Durchführung multinationaler Studien und macht es Unternehmen einfacher, Forschungen in mehreren Mitgliedstaaten der EU durchzuführen.
Die Wiederherstellung nach Katastrophen im Gesundheitswesen ist unverzichtbar
Die klinischen Studien der Gesundheitsbranche entwickeln sich hin zu Digitalisierung und Dezentralisierung, begleitet von einem Anstieg des Datenvolumens und einer tiefergehenden globalen Zusammenarbeit. Die Wiederherstellung nach Katastrophen ist für klinische Studien entscheidend, da sie die Datensicherheit, die Fortführung der Studien und die Einhaltung von Vorschriften gewährleistet. Sie trägt dazu bei, Studienausfälle oder Risiken für Patienten infolge von Datenverlusten oder Systemausfällen zu vermeiden.
Vinchin Backup & Recovery wurde entwickelt, um den Anforderungen von Gesundheitseinrichtungen bei der digitalen Transformation gerecht zu werden. Mit Unterstützung mehrerer Virtualisierungsplattformen wie VMware, Proxmox, XensServer, Oracle, Hyper-V und gängiger Datenbanken garantiert Vinchin eine hohe Verfügbarkeit und sichere Datensicherung. Funktionen wie Deduplizierung, Komprimierung und Cloud-Integration helfen dabei, Speicherressourcen zu optimieren und Wiederherstellungszeiten zu verkürzen. Zudem erfüllt Vinchin gesetzliche Vorgaben wie die DSGVO, schützt sensible Daten und stellt die Geschäftskontinuität im Krisenfall sicher. So können medizinische Einrichtungen ihre Aufmerksamkeit auf die Patientenversorgung konzentrieren und gleichzeitig auf vertrauenswürdige Datensicherheit vertrauen.
Es dauert nur 4 Schritte, um Ihre virtuelle Maschine oder Datenbank mit Vinchin Backup & Recovery zu sichern:
1. Wählen Sie das Sicherungsobjekt aus.
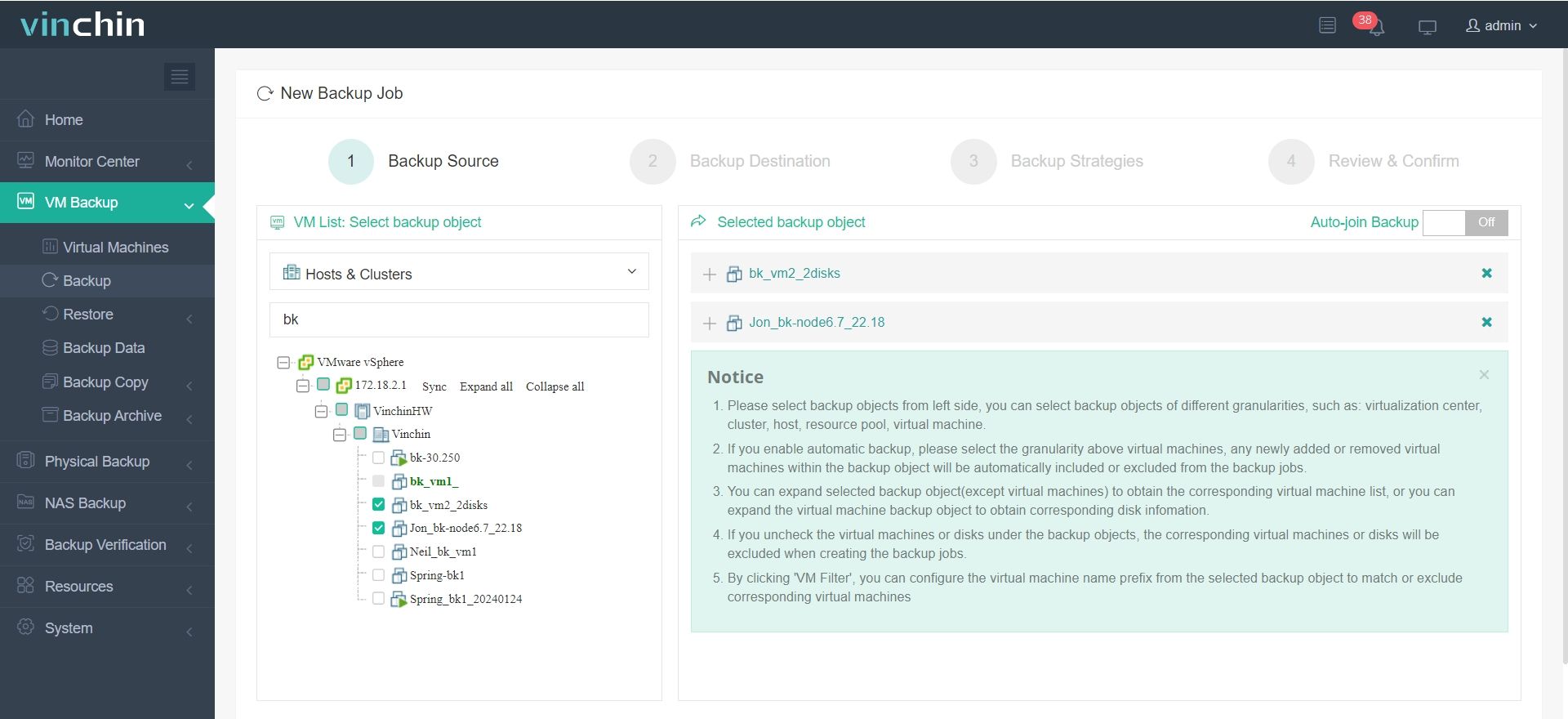
2. Sicherungsort auswählen.
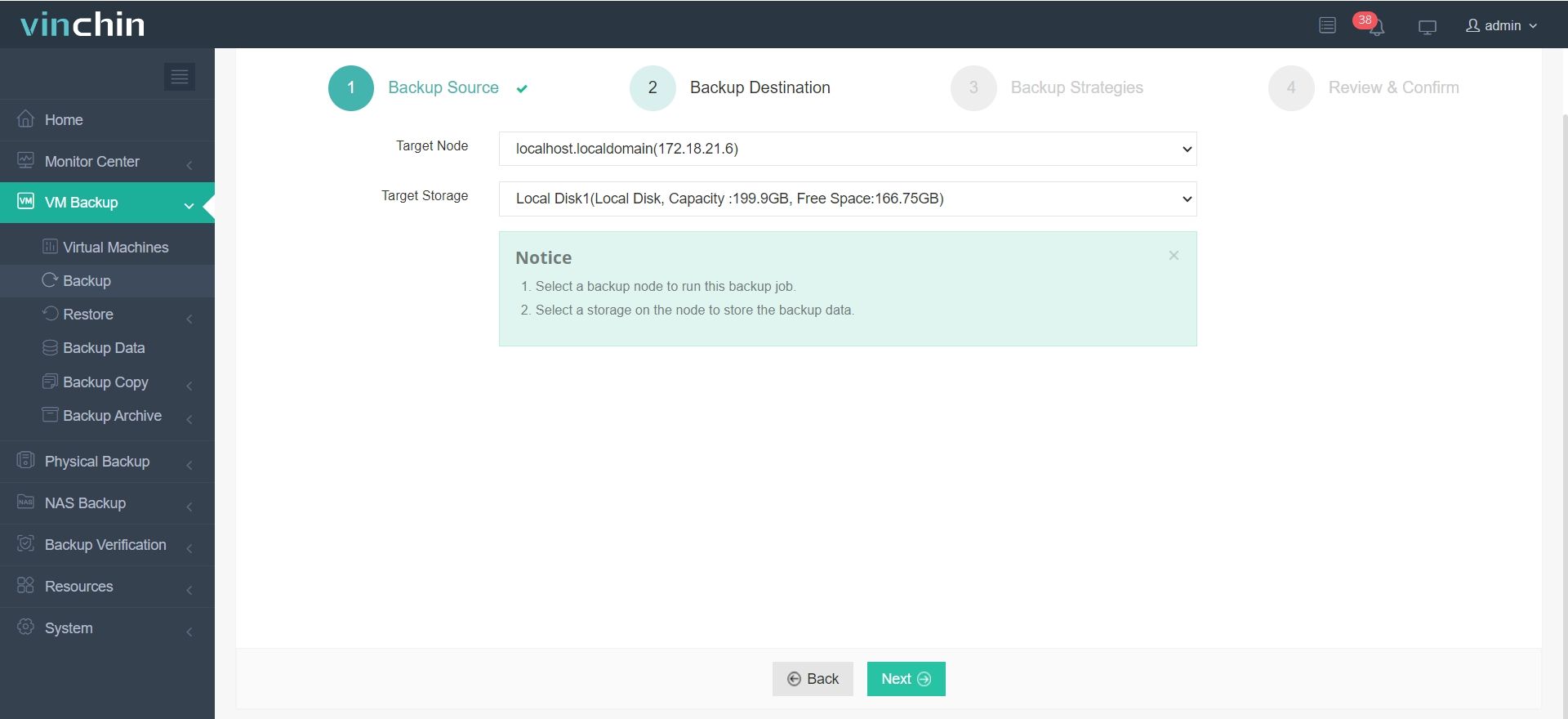
3. Sicherungsstrategien konfigurieren.
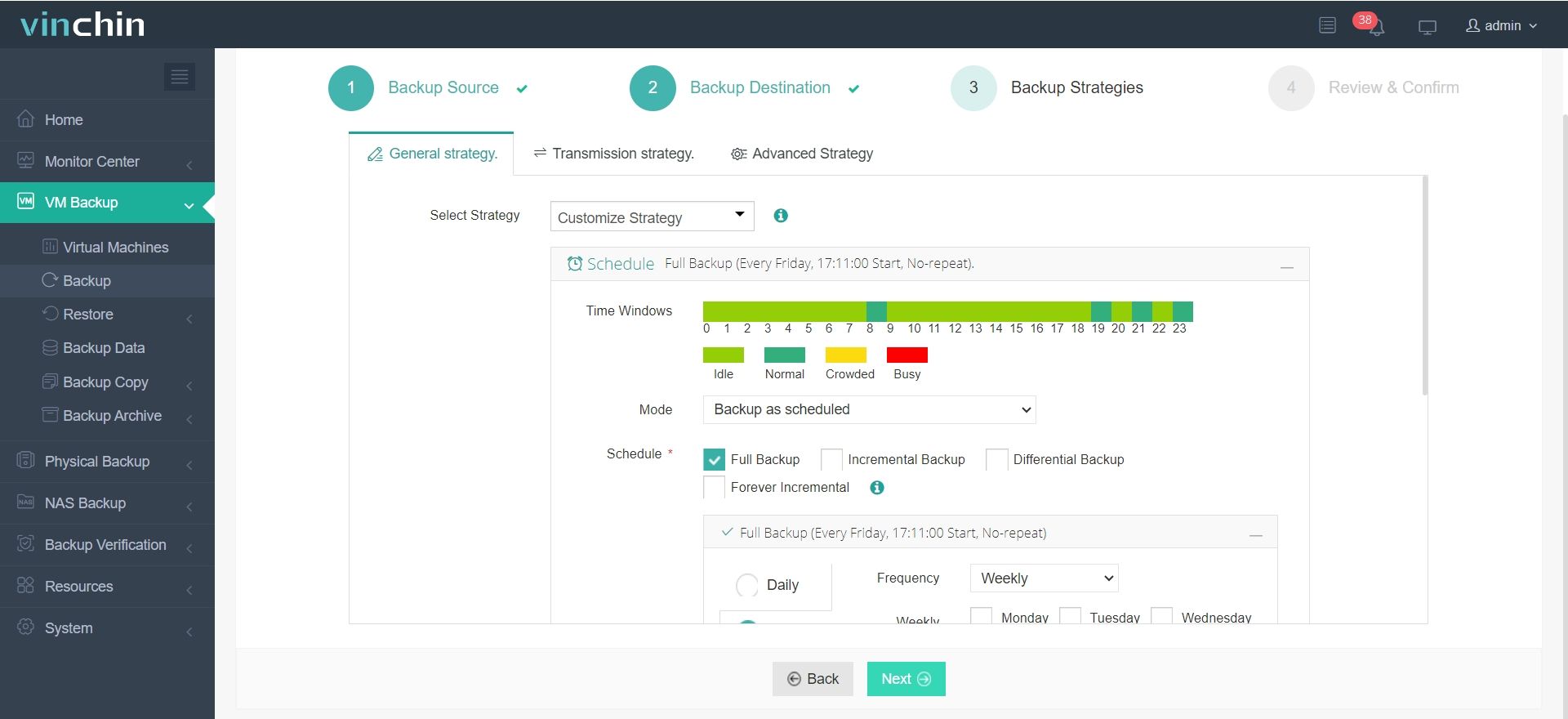
4. Überprüfen und Auftrag senden.
Entdecken Sie die Leistungsfähigkeit dieses umfassenden Systems hautnah mit einer kostenlosen 60-Tage-Testversion! Hinterlassen Sie Ihre spezifischen Anforderungen, und Sie erhalten eine maßgeschneiderte Lösung, die perfekt zu Ihrer IT-Umgebung passt.
GDPR klinische Studien FAQs
1. Was ist der Unterschied zwischen DSGVO und CTR?
Die DSGVO konzentriert sich auf den Datenschutz und die Privatsphäre, während die CTR die Durchführung klinischer Studien in der EU regelt. Allerdings überschneiden sich die beiden Verordnungen, und die Einhaltung beider ist erforderlich.
2. Können Teilnehmer ihre Einwilligung zur Datenverarbeitung zurückziehen, nachdem die Studie begonnen hat?
Ja, Teilnehmer können ihre Einwilligung zur Datenverarbeitung jederzeit widerrufen. Dies wirkt sich jedoch nicht auf die Rechtmäßigkeit der Verarbeitung aus, die vor dem Widerruf stattgefunden hat. Die Sponsoren müssen die Teilnehmer über dieses Recht während des Einwilligungsprozesses informieren.
Schlussfolgerung
In klinischen Studien ist der Schutz der Privatsphäre der Teilnehmer eine Achtung ihrer grundlegenden Rechte und eine notwendige Voraussetzung für die Einhaltung der Gesetze und ethischen Standards verschiedener Länder. Forscher und Institutionen sollten sicherstellen, dass die Erfassung, Speicherung, Nutzung und Weitergabe aller Daten den gesetzlichen Bestimmungen entsprechen, und effektive Maßnahmen ergreifen, um die persönlichen Informationen und die Datensicherheit der Teilnehmer zu schützen.
Teilen auf: