-
Che cos'è il GDPR?
-
Qual è il ruolo del GDPR negli studi clinici?
-
Regolamento dell'Unione europea sui trial clinici
-
Il ripristino dopo disastri sanitari è essenziale
-
FAQ GDPR sui trial clinici
-
Conclusione
Gli studi clinici contribuiscono al miglioramento continuo delle procedure diagnostiche e terapeutiche e rappresentano una parte indispensabile del progresso medico. Strettamente collegati agli studi clinici vi sono gli esami di laboratorio effettuati sui pazienti. Il processo prevede la gestione di grandi quantità di dati sanitari e genetici. È fondamentale che gli studi clinici rispettino le leggi sulla protezione dei dati. Dall'entrata in vigore del GDPR nei paesi europei, i servizi sanitari e i fornitori tecnologici hanno completamente rinnovato i loro modelli di lavoro tradizionali per garantire che le loro prestazioni mediche siano più interconnesse e centrate sul paziente.
Che cos'è il GDPR?
Il General Data Protection Regulation (GDPR) è una normativa stabilita dall'Unione Europea per proteggere la privacy e i dati personali degli individui all'interno dell'UE e dello Spazio Economico Europeo (SEE). È entrato in vigore il 25 maggio 2018, con l'obiettivo di dare alle persone un maggiore controllo sulle proprie informazioni personali e semplificare l'ambiente normativo per le imprese internazionali, unificando le leggi sulla protezione dei dati in tutta Europa. Il GDPR impone linee guida rigorose su come le aziende raccolgono, elaborano, archiviano e trasferiscono i dati personali.
Secondo il GDPR, le organizzazioni devono ottenere il consenso esplicito degli individui per elaborare i loro dati, garantire il diritto di accesso, correzione e cancellazione dei dati, e segnalare qualsiasi violazione dei dati entro 72 ore. Il mancato rispetto del GDPR può comportare multe salate, fino al 4% del fatturato globale annuo dell'azienda o 20 milioni di euro (a seconda di quale importo sia maggiore). La normativa pone l'accento su trasparenza, responsabilizzazione e sicurezza, con l'obiettivo di garantire che vengano rispettati i diritti alla privacy degli individui, consentendo al contempo alle aziende di operare in un'economia digitale globale.
Qual è il ruolo del GDPR negli studi clinici?
Dati alla luce del GDPR, i dati sanitari sono considerati dati sensibili. Facilitare lo scambio di dati sanitari tra gli Stati membri è diventato sempre più importante nel settore della salute pubblica, con misure che includono principalmente l'erogazione di cure sanitarie o trattamenti, la prevenzione di gravi minacce transfrontaliere per i dati sanitari e il garanzia di elevati standard di assistenza sanitaria e di qualità e sicurezza dei prodotti o dispositivi medici. Il GDPR stabilisce regole per garantire un trattamento e uno scambio legali e affidabili di dati sanitari all'interno dell'UE; tali norme si applicano anche ai soggetti terzi che ottengono dati medici dei pazienti, inclusi riepiloghi dei pazienti, ricette elettroniche e registrazioni sanitarie elettroniche complete e a lungo termine, così come all'utilizzo di tali dati per scopi di ricerca scientifica.
Il trasferimento transfrontaliero dei dati relativi a studi clinici coinvolge diversi aspetti, come le leggi nazionali, i regolamenti e la protezione della privacy. Ad esempio, negli Stati Uniti il trasferimento transfrontaliero dei dati relativi a studi clinici è tutelato dal Health Insurance Portability and Accountability Act (HIPAA), che mira a garantire la sicurezza e la riservatezza delle informazioni mediche. HIPAA richiede che le informazioni sanitarie personali siano protette da misure di privacy equivalenti a quelle statunitensi quando vengono trasferite all'estero. L'Unione Europea, invece, ha adottato il GDPR, che si applica al trasferimento transfrontaliero di dati personali, compresi quelli relativi agli studi clinici. La maggior parte dei paesi non appartenenti all'UE richiede inoltre che i trasferimenti di dati siano protetti a un livello equivalente a quello delle protezioni interne.
Nel campo dei trial clinici decentralizzati (DCT), il GDPR svolge altresì un ruolo importante. Le firme elettroniche vengono utilizzate sempre più frequentemente negli scenari DCT. Alcuni Paesi/regioni richiedono la verifica dell'identità del partecipante tramite collegamento video al momento della fornitura della firma elettronica. A seconda della classificazione del rischio e del livello di intervento del trial clinico, potrebbero essere richiesti diversi tipi di firma elettronica e tutte le formule di consenso elettronico/le firme elettroniche devono rispettare il GDPR. Generalmente, è una buona pratica, e a volte necessario, effettuare una valutazione d'impatto sulla protezione dei dati per analizzare i rischi dal punto di vista della privacy dei dati quando si utilizzano moduli elettronici di consenso.
Anche i dati raccolti devono rispettare gli stessi standard GCP di qualsiasi altro metodo di raccolta dati. Qualora vi siano dubbi sulla qualità dei dati, si dovrebbe valutare la possibilità di effettuare un nuovo monitoraggio. Inoltre, tutti i trattamenti di dati personali rientranti nell'ambito del DCT devono conformarsi al GDPR.
Regolamento dell'Unione europea sui trial clinici
Il Regolamento dell'Unione europea sui trial clinici (CTR) è un regolamento finalizzato a standardizzare e migliorare il processo di svolgimento dei trial clinici nell'UE. È stato introdotto per potenziare la sicurezza dei pazienti, aumentare la trasparenza e semplificare il processo di approvazione dei trial clinici, il che è particolarmente importante nel contesto del panorama della ricerca medica in rapida evoluzione. Il regolamento è entrato in vigore il 31 gennaio 2022, sostituendo la precedente Direttiva sui trial clinici.
Il CTR introduce un sistema centralizzato per la presentazione delle domande di sperimentazione clinica a livello UE, semplificando il processo di approvazione e riducendo gli oneri amministrativi per i promotori. Prevede inoltre una maggiore trasparenza, rendendo pubblicamente accessibili i risultati delle sperimentazioni cliniche attraverso il registro europeo delle sperimentazioni cliniche. Il regolamento garantisce una tutela più rigorosa per i partecipanti alle sperimentazioni, comprese procedure di consenso informato più severe e un monitoraggio più accurato dell'andamento delle prove. Inoltre, agevola la realizzazione di studi multinazionali, rendendo più semplice per le aziende effettuare ricerche in più Stati membri dell'UE.
Il ripristino dopo disastri sanitari è essenziale
Gli studi clinici del settore sanitario stanno progressivamente digitalizzandosi e decentralizzandosi, con un aumento del volume di dati e una collaborazione globale più approfondita. Il ripristino dopo disastri è fondamentale per gli studi clinici, poiché garantisce sicurezza dei dati, continuità degli studi e conformità alle normative. Aiuta a prevenire il fallimento degli studi o i rischi per i pazienti causati dalla perdita di dati o da interruzioni del sistema.
Vinchin Backup & Recovery è progettato per soddisfare le esigenze di protezione dei dati delle organizzazioni sanitarie che affrontano la trasformazione digitale. Con il supporto per diverse piattaforme di virtualizzazione come VMware, Proxmox, XensServer, Oracle, Hyper-V e database popolari, Vinchin garantisce alta disponibilità e backup sicuri dei dati. Funzionalità quali deduplica, compressione e integrazione con il cloud aiutano a ottimizzare l'archiviazione e migliorare i tempi di ripristino. Inoltre, Vinchin rispetta regolamenti come il GDPR, tutelando informazioni sensibili e assicurando la continuità operativa in caso di disastri. Questo permette ai fornitori di assistenza sanitaria di concentrarsi sull'assistenza ai pazienti mantenendo una protezione affidabile dei dati.
Basta seguire 4 passaggi per eseguire il backup della tua macchina virtuale o del database con Vinchin Backup & Recovery:
1.Selezionare l'oggetto di backup.
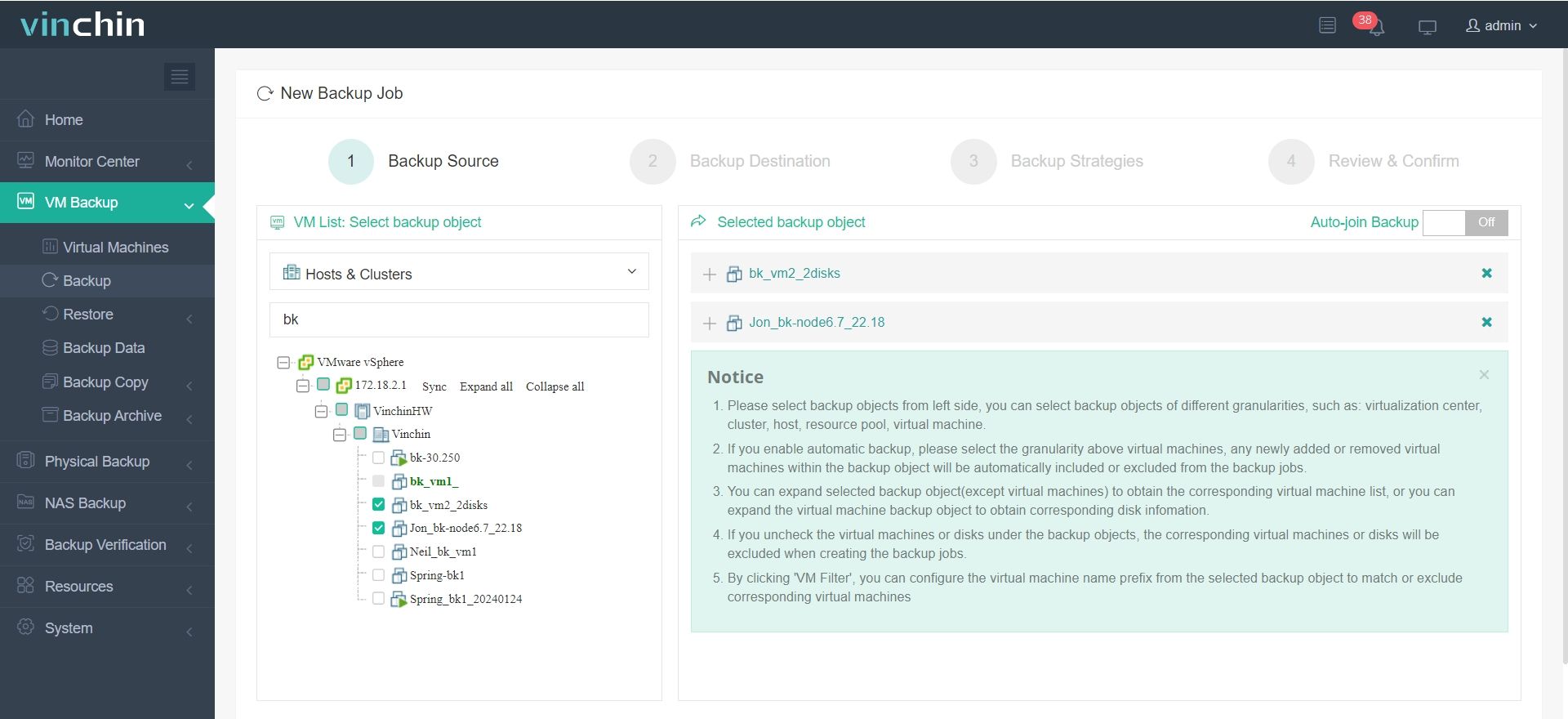
2.Selezionare la destinazione del backup.
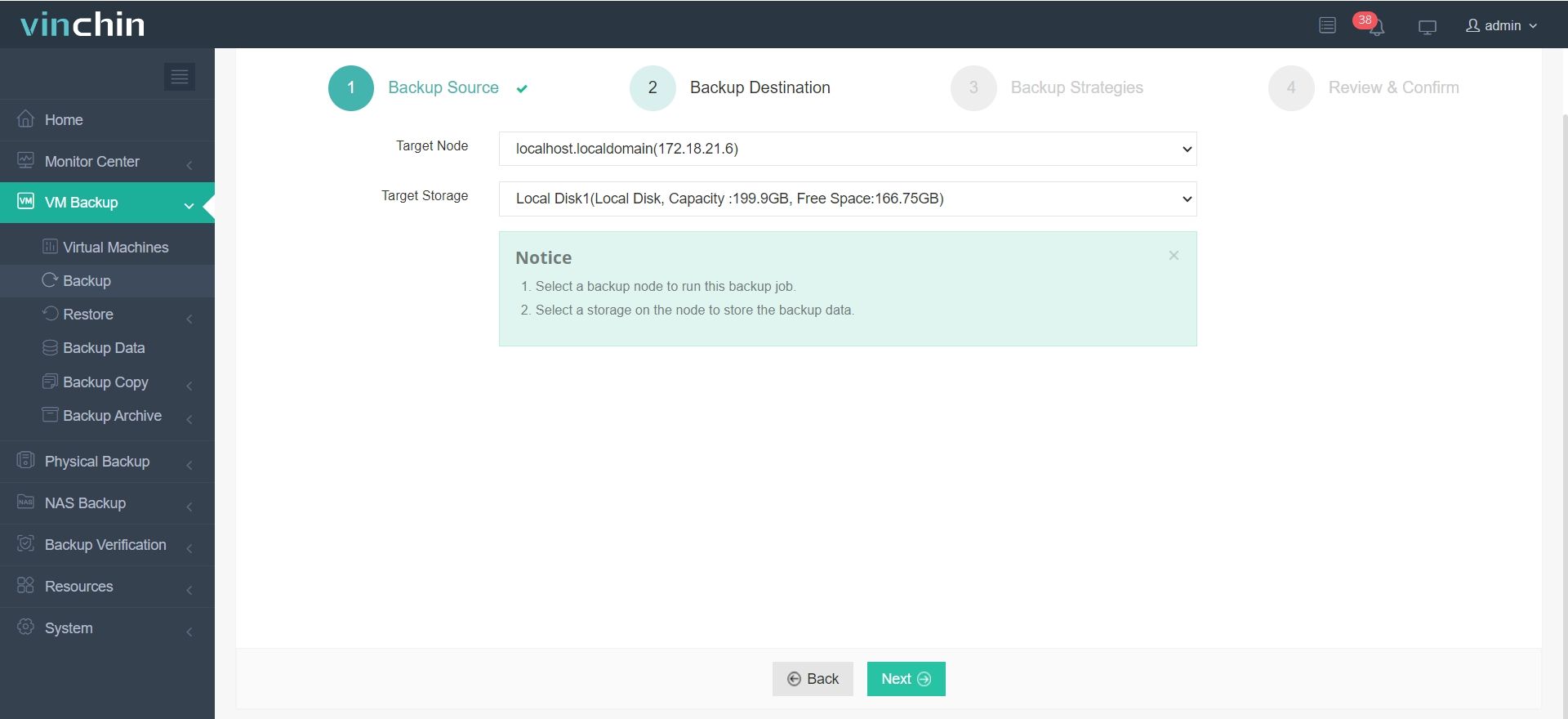
3.Configura le strategie di backup.
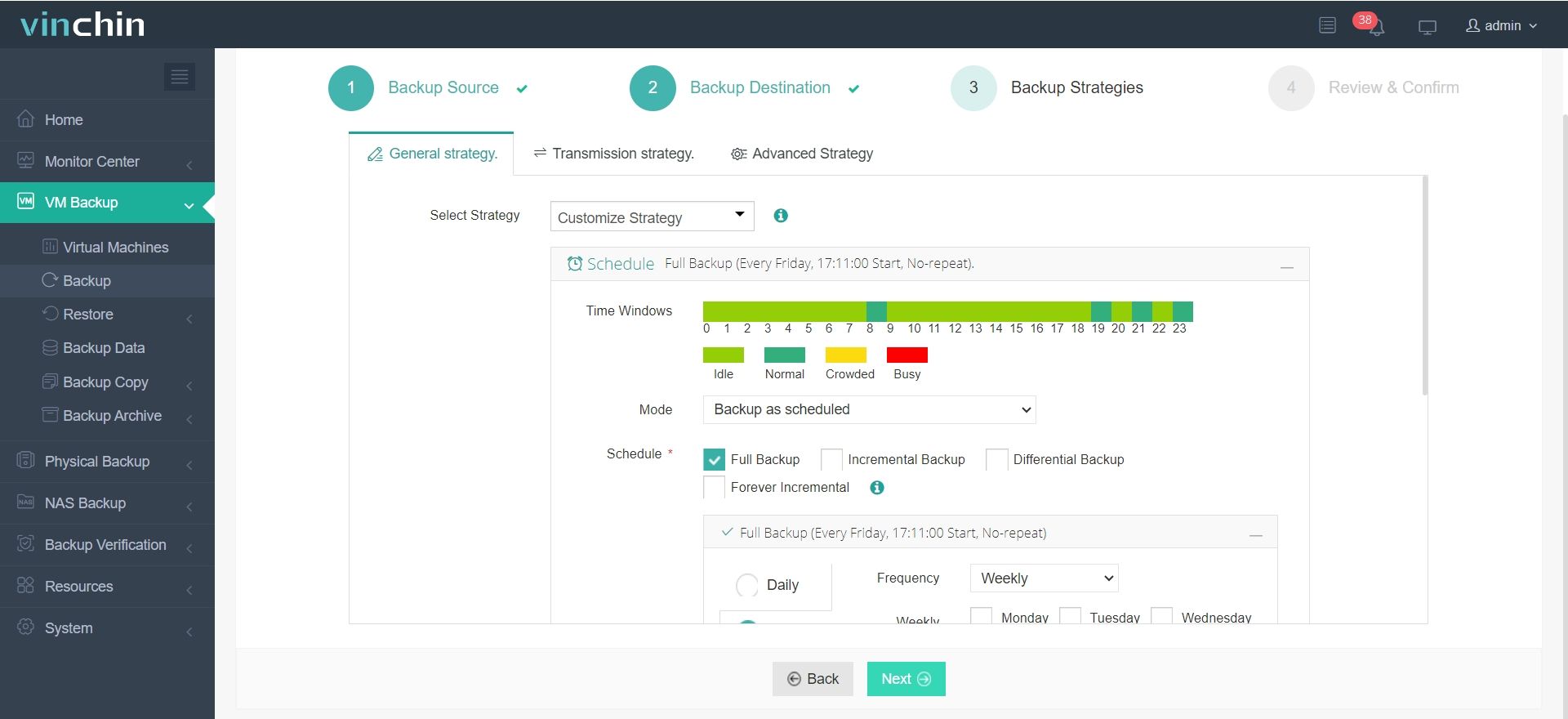
4. Rivedi e invia il lavoro.
Scopri in prima persona la potenza di questo sistema completo con una prova gratuita di 60 giorni! Lascia le tue esigenze specifiche, e riceverai una soluzione personalizzata che si adatta perfettamente al tuo ambiente IT.
FAQ GDPR sui trial clinici
1. Qual è la differenza tra GDPR e CTR?
Il GDPR si concentra sulla protezione dei dati e sulla privacy, mentre il CTR regola lo svolgimento dei trial clinici nell'UE. Tuttavia, le due normative si sovrappongono e la conformità a entrambe è richiesta.
2. I partecipanti possono revocare il proprio consenso al trattamento dei dati dopo l'inizio della sperimentazione?
Sì, i partecipanti possono revocare il consenso al trattamento dei dati in qualsiasi momento. Tuttavia, ciò non influisce sulla legittimità del trattamento effettuato prima della revoca. I promotori devono informare i partecipanti di questo diritto durante il processo di consenso.
Conclusione
Nelle sperimentazioni cliniche, proteggere la privacy dei partecipanti rappresenta un rispetto dei loro diritti fondamentali ed è una condizione necessaria per conformarsi alle leggi e agli standard etici dei diversi paesi. I ricercatori e le istituzioni dovrebbero garantire che la raccolta, l'archiviazione, l'utilizzo e la condivisione di dati siano in linea con le normative vigenti, adottando efficaci misure di protezione delle informazioni personali e della sicurezza della privacy dei partecipanti.
Condividi su: