-
Qu'est-ce que le GDPR ?
-
Quel est le rôle du RGPD dans les essais cliniques ?
-
Règlement de l'Union européenne sur les essais cliniques
-
La reprise après sinistre dans le domaine de la santé est essentielle
-
FAQ sur les essais cliniques et le GDPR
-
Conclusion
Les essais cliniques contribuent à l'amélioration continue des procédures de diagnostic et de traitement et représentent une composante indispensable du progrès médical. Les examens et tests de laboratoire réalisés sur les patients sont étroitement liés à ces essais cliniques. Le processus implique la gestion d'importantes quantités de données médicales et génétiques. Il est essentiel que les essais cliniques respectent les lois relatives à la protection des données. Depuis l'application du RGPD dans les pays européens, les services de santé et les fournisseurs de technologies ont profondément modifié leurs modèles traditionnels de fonctionnement afin d'assurer une offre de soins davantage interconnectée et centrée sur le patient.
Qu'est-ce que le GDPR ?
Le Règlement Général sur la Protection des Données (GDPR) est un règlement établi par l'Union européenne afin de protéger la vie privée et les données personnelles des individus résidant dans l'Union européenne et l'Espace économique européen (EEE). Il a été mis en œuvre le 25 mai 2018, avec pour objectif de donner aux individus un plus grand contrôle sur leurs informations personnelles et de simplifier l'environnement réglementaire pour les entreprises internationales en unifiant les lois européennes relatives à la protection des données. Le RGPD impose des directives strictes concernant la manière dont les entreprises collectent, traitent, stockent et transfèrent les données personnelles.
En vertu du RGPD, les organisations doivent obtenir le consentement explicite des individus pour traiter leurs données, leur offrir le droit d'accéder à ces données, de les corriger et de les supprimer, ainsi que signaler tout incident de sécurité dans un délai de 72 heures. Le non-respect du RGPD peut entraîner des amendes importantes, allant jusqu'à 4 % du chiffre d'affaires mondial annuel de l'entreprise ou 20 millions d'euros (selon le montant le plus élevé). Cette réglementation met l'accent sur la transparence, la responsabilité et la sécurité, visant à garantir le respect des droits à la vie privée des individus tout en permettant aux entreprises de fonctionner dans une économie numérique mondiale.
Quel est le rôle du RGPD dans les essais cliniques ?
Conformément au GDPR, les données de santé sont considérées comme des données sensibles. Faciliter l'échange de données de santé entre les États membres est devenu un enjeu croissant dans le secteur de la santé publique, notamment pour permettre la fourniture de soins ou de traitements, prévenir les menaces graves transfrontalières pour la santé, ainsi que garantir des normes élevées en matière de soins, et assurer la qualité et la sécurité des produits ou dispositifs médicaux. Le GDPR établit des règles visant à garantir un traitement légal et fiable des données de santé au sein de l'Union européenne. Il s'applique également aux tiers qui accèdent aux données médicales des patients, notamment les résumés des dossiers médicaux, les ordonnances électroniques et les dossiers de santé complets et permanents, ainsi qu'à l'utilisation de ces données à des fins de recherche scientifique.
Le transfert transfrontalier des données d'essais cliniques implique de nombreux aspects tels que les lois nationales, la réglementation et la protection de la vie privée. Par exemple, aux États-Unis, le transfert transfrontalier des données d'essais cliniques est protégé par la loi sur la portabilité et la responsabilité de l'assurance maladie (HIPAA), destinée à garantir la sécurité et la confidentialité des informations médicales. HIPAA exige que les informations personnelles relatives à la santé bénéficient, lorsqu'elles sont transférées à l'étranger, de mesures de protection de la vie privée similaires à celles appliquées aux États-Unis. L'Union européenne, quant à elle, a mis en place le GDPR, qui s'applique au transfert transfrontalier des données personnelles, y compris des données d'essais cliniques. La plupart des pays non membres de l'UE exigent également que les transferts de données soient protégés à un niveau similaire à celui des protections internes.
Dans le domaine des essais cliniques décentralisés (DCT), le GDPR joue également un rôle. Les signatures électroniques sont de plus en plus utilisées dans les scénarios DCT. Certains pays/régions exigent une vérification de l'identité des participants par lien vidéo lors de la fourniture d'une signature électronique. En fonction de la classification du risque et du niveau d'intervention de l'essai clinique, différents types de signatures électroniques peuvent être requis, et tous les formulaires de consentement électroniques/signatures électroniques doivent respecter le GDPR. Généralement, il est recommandé, et parfois nécessaire, de réaliser une analyse d'impact sur la protection des données afin d'évaluer les risques liés à la confidentialité des données lors de l'utilisation de formulaires de consentement électroniques.
En outre, les données recueillies doivent respecter les mêmes normes d’assurance qualité (GCP) que tout autre mode de collecte de données. Si des doutes subsistent quant à la qualité des données, une nouvelle vérification devrait être envisagée. Par ailleurs, tout traitement des données à caractère personnel dans le cadre du DCT doit être conforme au Règlement Général sur la Protection des Données (GDPR).
Règlement de l'Union européenne sur les essais cliniques
Le règlement de l'Union européenne sur les essais cliniques (CTR) est un règlement visant à normaliser et améliorer le processus de réalisation des essais cliniques dans toute l'UE. Il a été introduit afin d'améliorer la sécurité des patients, d'accroître la transparence et de simplifier le processus d'autorisation des essais cliniques, ce qui est particulièrement important dans le contexte de l'évolution rapide du paysage de la recherche médicale. Le règlement est entré en vigueur le 31 janvier 2022, remplaçant ainsi l'ancienne directive sur les essais cliniques.
Le CTR introduit un système centralisé de soumission des demandes d'essais cliniques valable dans toute l'Union européenne, simplifiant ainsi le processus d'autorisation et réduisant les charges administratives pour les promoteurs. Il exige également une plus grande transparence, les résultats des essais cliniques devant être accessibles au public via le Registre européen des essais cliniques. Le règlement garantit une meilleure protection des participants aux essais, notamment par des procédures de consentement éclairé plus strictes et un suivi renforcé de l'avancement des essais. Il facilite également la réalisation d'essais multinationaux, rendant plus aisé pour les entreprises de mener des recherches dans plusieurs États membres de l'UE.
La reprise après sinistre dans le domaine de la santé est essentielle
L'industrie pharmaceutique s'oriente progressivement vers la numérisation et la décentralisation des essais cliniques, avec une augmentation significative du volume de données et une coopération mondiale plus approfondie. La reprise après sinistre est cruciale pour les essais cliniques, car elle garantit la sécurité des données, la continuité des essais et la conformité aux réglementations. Elle permet d'éviter les échecs des essais ou les risques pour les patients causés par la perte de données ou des perturbations système.
Vinchin Backup & Recovery est conçu pour répondre aux besoins de protection des données des organisations du secteur de la santé confrontées à la transformation numérique. Grâce à sa compatibilité avec plusieurs plateformes de virtualisation telles que VMware, Proxmox, XensServer, Oracle, Hyper-V et les bases de données populaires, Vinchin garantit une haute disponibilité et des sauvegardes de données sécurisées. Des fonctionnalités telles que la déduplication, la compression et l’intégration cloud permettent d’optimiser le stockage et d’améliorer les temps de restauration. De plus, Vinchin respecte des réglementations telles que le RGPD, protègeant ainsi les informations sensibles et assurant la continuité de l’activité en cas de sinistre. Cela permet aux prestataires de soins de se concentrer sur la prise en charge des patients tout en maintenant une sécurité des données fiable.
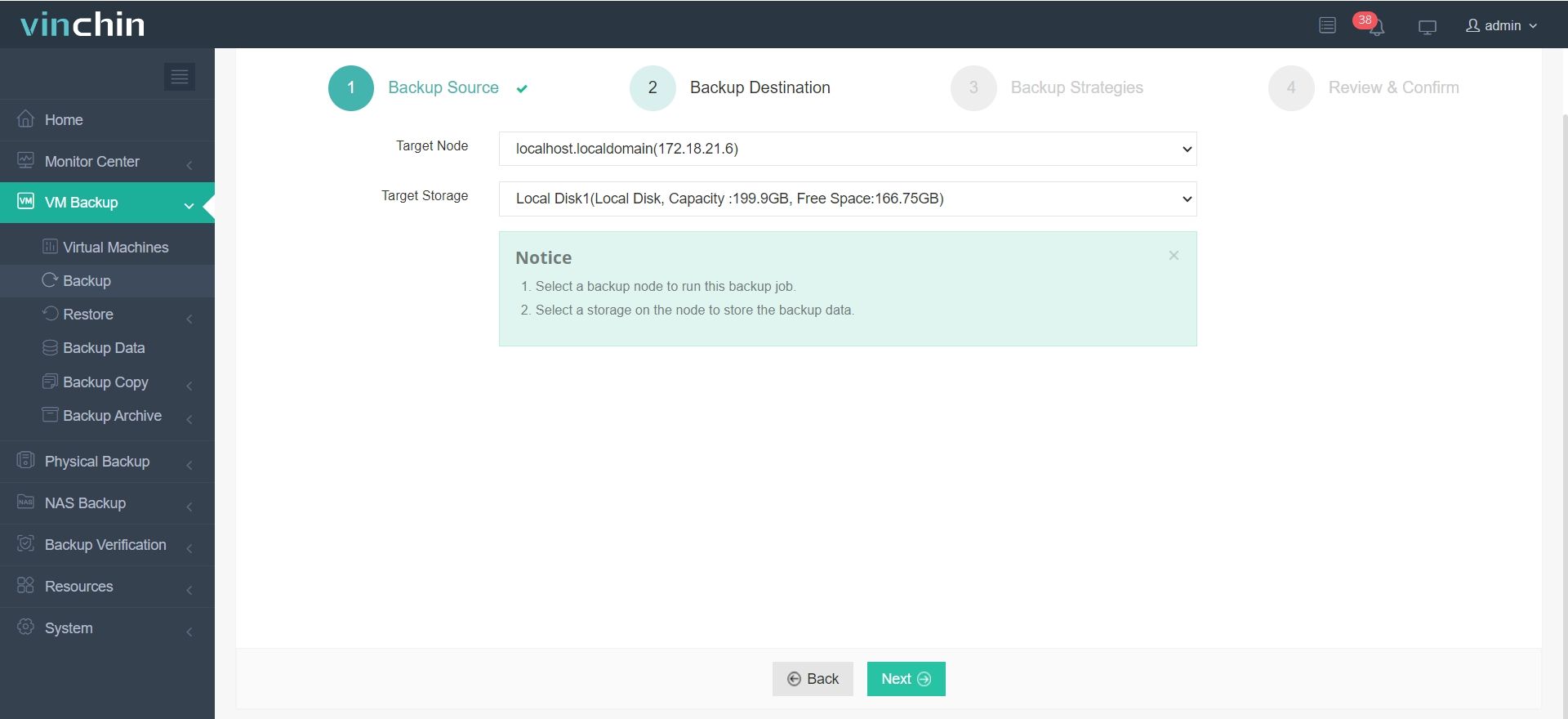
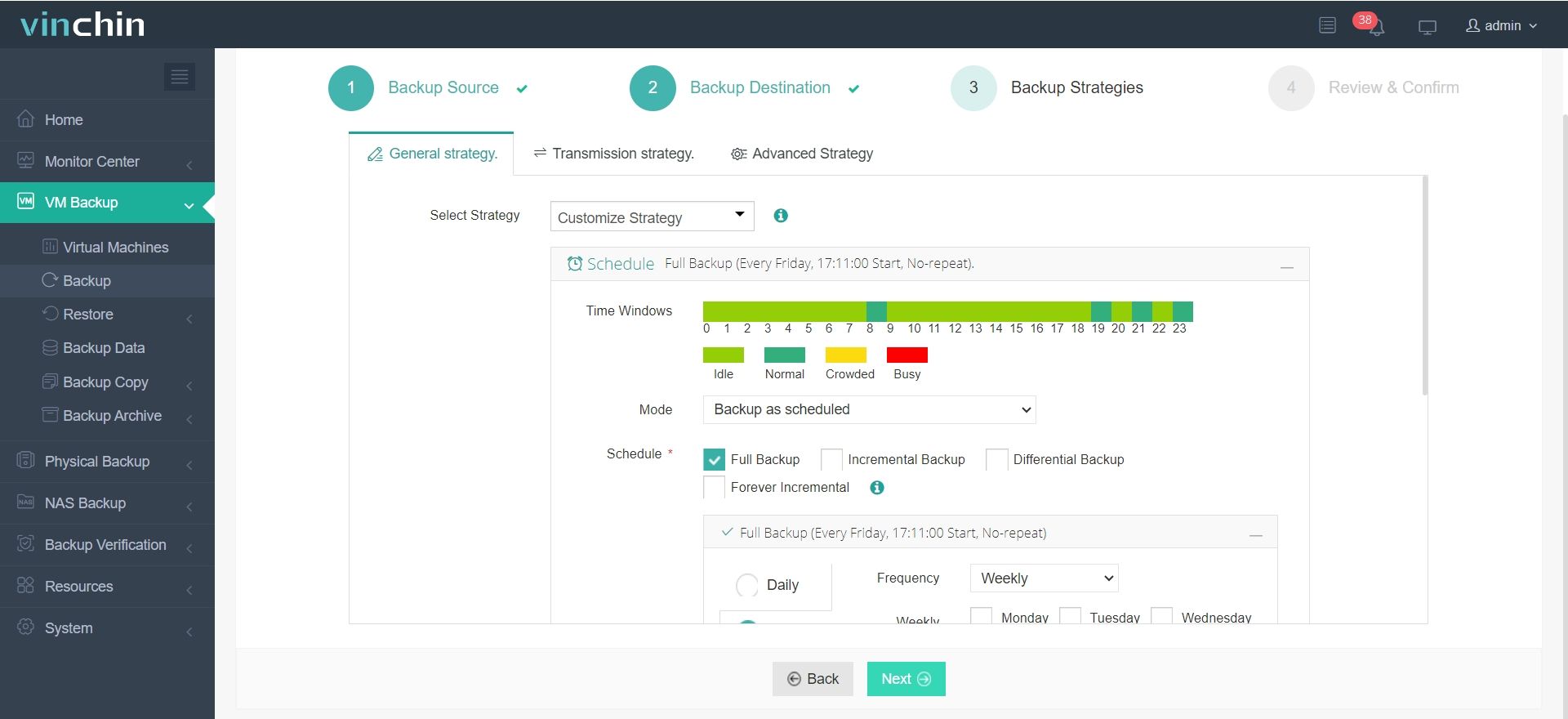
Il suffit de 4 étapes pour sauvegarder votre machine virtuelle ou base de données avec Vinchin Backup & Recovery :
1.Sélectionnez l'objet de sauvegarde.
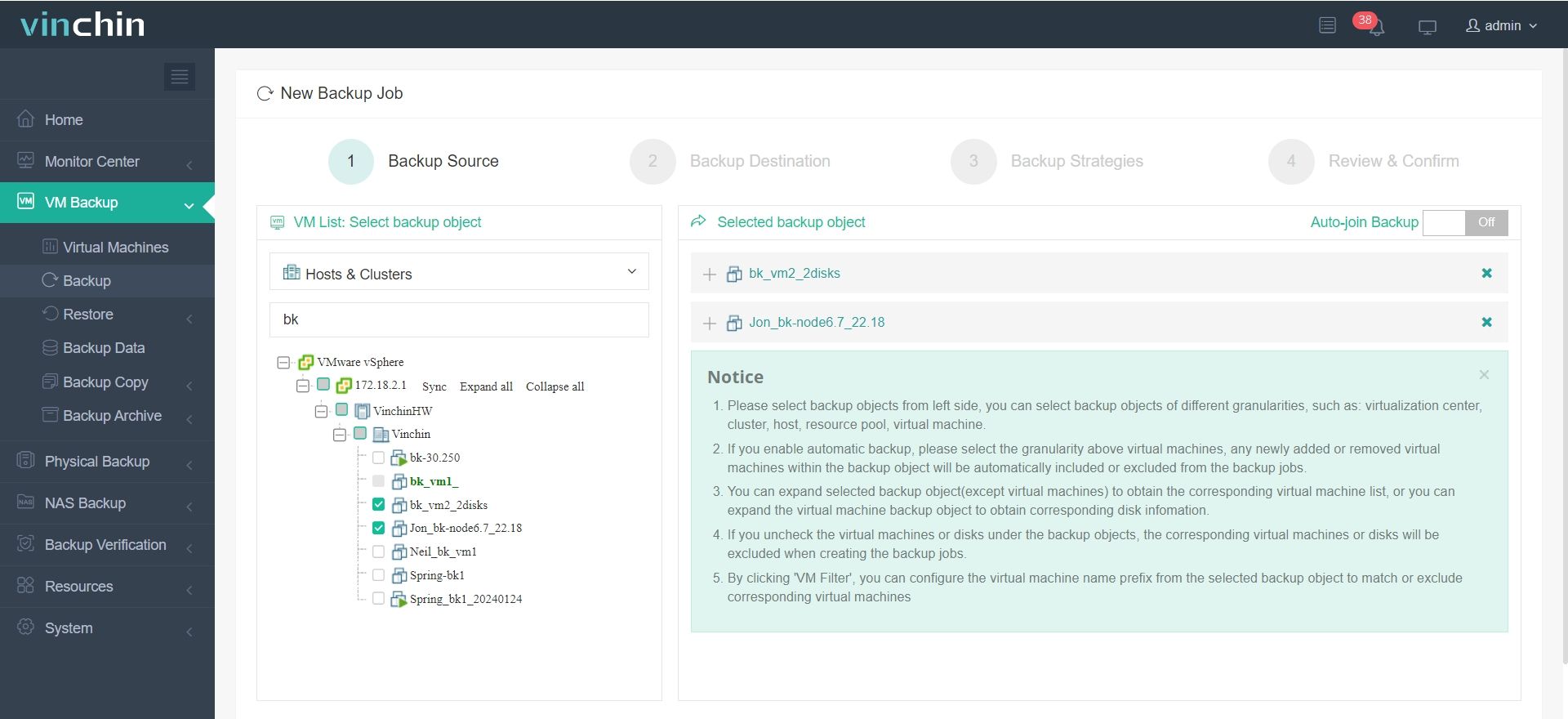
2.Sélectionnez la destination de la sauvegarde.
3.Configurer les stratégies de sauvegarde.
4. Consulter et soumettre l'offre d'emploi.
Découvrez par vous-même la puissance de ce système complet avec un essai gratuit de 60 jours ! Indiquez vos besoins spécifiques, et vous obtiendrez une solution personnalisée qui s'adaptera parfaitement à votre environnement informatique.
FAQ sur les essais cliniques et le GDPR
1. Quelle est la différence entre le GDPR et le CTR ?
Le GDPR se concentre sur la protection des données et la vie privée, tandis que le CTR régit la réalisation des essais cliniques dans l'Union européenne. Toutefois, ces deux réglementations se chevauchent, et il est nécessaire de se conformer aux deux.
2. Les participants peuvent-ils retirer leur consentement au traitement des données après le début de l'essai ?
Oui, les participants peuvent retirer leur consentement au traitement des données à tout moment. Toutefois, cela n'affecte pas la légalité du traitement effectué avant le retrait. Les promoteurs doivent informer les participants de ce droit pendant le processus de consentement.
Conclusion
Dans les essais cliniques, la protection de la vie privée des participants constitue un respect de leurs droits fondamentaux et une condition nécessaire pour se conformer aux lois et normes éthiques des différents pays. Les chercheurs et les institutions doivent s'assurer que la collecte, le stockage, l'utilisation et le partage de toutes les données soient conformes à la réglementation en vigueur, et prendre des mesures efficaces pour protéger les informations personnelles et la sécurité de la vie privée des participants.
Partager sur: