-
¿Qué es el GDPR?
-
¿Cuál es el papel del GDPR en los ensayos clínicos?
-
Reglamento de la Unión Europea sobre Ensayos Clínicos
-
La recuperación ante desastres en salud es esencial
-
Preguntas frecuentes sobre ensayos clínicos del RGPD
-
Conclusión
Los ensayos clínicos contribuyen a la mejora continua de los procedimientos de diagnóstico y tratamiento y son una parte indispensable del progreso médico. Estrechamente relacionados con los ensayos clínicos están las pruebas y exámenes de laboratorio realizados en pacientes. El proceso implica manejar grandes cantidades de datos genéticos y de salud. Es crucial que los ensayos clínicos cumplan con las leyes de protección de datos. Desde la implementación del GDPR en los países europeos, los servicios de salud y los proveedores de tecnología han reformado exhaustivamente sus modelos tradicionales de trabajo para garantizar que sus servicios médicos sigan siendo más interconectados y centrados en el paciente.
¿Qué es el GDPR?
El Reglamento General de Protección de Datos (GDPR) es un reglamento establecido por la Unión Europea para proteger la privacidad y los datos personales de los individuos dentro de la UE y del Espacio Económico Europeo (EEE). Entró en vigor el 25 de mayo de 2018, con el objetivo de dar a los individuos mayor control sobre su información personal y simplificar el entorno regulatorio para el comercio internacional al unificar las leyes de protección de datos en Europa. El GDPR establece pautas estrictas sobre cómo las empresas recopilan, procesan, almacenan y transfieren datos personales.
Bajo el RGPD, las organizaciones deben obtener el consentimiento explícito de las personas para procesar sus datos, garantizar el derecho de acceso, rectificación y eliminación de los datos, y notificar cualquier violación de datos en un plazo de 72 horas. El incumplimiento del RGPD puede conllevar multas elevadas, hasta el 4% del volumen de negocio global anual de la empresa o 20 millones de euros (lo que sea mayor). La regulación destaca la transparencia, la responsabilidad y la seguridad, con el objetivo de garantizar que se respeten los derechos de privacidad de las personas, al mismo tiempo que permite a las empresas operar en una economía digital global.
¿Cuál es el papel del GDPR en los ensayos clínicos?
Según el GDPR, los datos de salud se consideran datos sensibles. Facilitar el intercambio de datos de salud entre Estados miembros se ha vuelto cada vez más importante en el sector de la salud pública, con medidas que incluyen principalmente la prestación de servicios médicos o tratamiento, la prevención de amenazas graves transfronterizas para los datos de salud, y garantizar altos estándares de atención médica, así como la calidad y seguridad de productos o dispositivos médicos. El GDPR establece normas para garantizar un procesamiento y intercambio legal y seguro de datos de salud dentro de la UE, y también se aplica a terceros que obtengan datos médicos de pacientes, incluyendo resúmenes médicos del paciente, recetas electrónicas y registros electrónicos de salud completos y permanentes, así como al uso de estos datos con fines de investigación científica.
El traslado transfronterizo de datos de ensayos clínicos involucra múltiples aspectos tales como leyes nacionales, regulaciones y protección de la privacidad. Por ejemplo, en Estados Unidos, el traslado transfronterizo de datos de ensayos clínicos está protegido por la Ley de Portabilidad y Responsabilidad del Seguro de Salud (HIPAA), dedicada a garantizar la seguridad y privacidad de la información médica. HIPAA requiere que la información de salud personal esté protegida mediante medidas de privacidad similares a las utilizadas dentro de Estados Unidos cuando se transfiere al extranjero. Por otro lado, la Unión Europea ha implementado el Reglamento General de Protección de Datos (GDPR), que se aplica al traslado transfronterizo de datos personales, incluyendo los datos de los ensayos clínicos. La mayoría de los países no pertenecientes a la UE también exigen que las transferencias de datos estén protegidas a un nivel similar al de las protecciones internas.
En el ámbito de los ensayos clínicos descentralizados (DCT), el RGPD también desempeña un papel importante. Las firmas electrónicas se están utilizando cada vez más en escenarios DCT. Algunos países o regiones requieren la verificación de identidad de los participantes mediante enlace de video al proporcionar firmas electrónicas. Dependiendo de la clasificación del riesgo y el nivel de intervención del ensayo clínico, puede requerirse distintos tipos de firmas electrónicas, y todos los formularios de consentimiento electrónicos/firmas electrónicas deben cumplir con el RGPD. Generalmente, es una buena práctica, y en ocasiones necesario, realizar una evaluación de impacto en la protección de datos para analizar los riesgos desde la perspectiva de privacidad de los datos cuando se utilizan formularios de consentimiento electrónicos.
Además, los datos recopilados deben cumplir con las mismas normas GCP que cualquier otro método de recopilación de datos. Si existen dudas sobre la calidad de los datos, se debe considerar una nueva supervisión. Asimismo, todo procesamiento de datos personales dentro del ámbito del DCT debe cumplir con el RGPD.
Reglamento de la Unión Europea sobre Ensayos Clínicos
El Reglamento de la Unión Europea sobre Ensayos Clínicos (CTR) es un reglamento diseñado para normalizar y mejorar el proceso de realización de ensayos clínicos en toda la UE. Fue introducido para potenciar la seguridad de los pacientes, incrementar la transparencia y simplificar el proceso de aprobación de ensayos clínicos, lo cual es especialmente importante en el contexto del rápido avance del panorama de investigación médica. El reglamento entró en vigor el 31 de enero de 2022, reemplazando a la anterior Directiva sobre Ensayos Clínicos.
El CTR introduce un sistema centralizado de presentación de solicitudes de ensayos clínicos válido en toda la UE, agilizando el proceso de aprobación y reduciendo la carga administrativa para los promotores. También exige una mayor transparencia, haciendo accesibles al público los resultados de los ensayos clínicos a través del Registro Europeo de Ensayos Clínicos. La regulación garantiza una protección más fuerte para los participantes en ensayos, incluyendo procesos de consentimiento informado más estrictos y una supervisión más rigurosa del avance de los ensayos. Además, facilita la realización de ensayos multinationales, haciendo más fácil para las empresas llevar a cabo investigaciones en múltiples Estados miembros de la UE.
La recuperación ante desastres en salud es esencial
Los ensayos clínicos de la industria sanitaria están avanzando hacia la digitalización y la descentralización, con un aumento del volumen de datos y una colaboración global más profunda. La recuperación ante desastres es crucial para los ensayos clínicos, ya que garantiza la seguridad de los datos, la continuidad del ensayo y el cumplimiento de las regulaciones. Ayuda a prevenir fallos en los ensayos o riesgos para los pacientes causados por pérdida de datos o interrupciones en los sistemas.
Vinchin Backup & Recovery está diseñado para satisfacer las necesidades de protección de datos de las organizaciones sanitarias que afrontan una transformación digital. Con soporte para múltiples plataformas de virtualización como VMware, Proxmox, XensServer, Oracle, Hyper-V y bases de datos populares, Vinchin garantiza alta disponibilidad y copias de seguridad seguras. Funcionalidades como la deduplicación, compresión e integración en la nube ayudan a optimizar el almacenamiento y mejorar los tiempos de recuperación. Además, Vinchin cumple con regulaciones como el RGPD, salvaguardando información sensible y asegurando la continuidad del negocio en caso de desastres. Esto permite a los proveedores de atención médica concentrarse en el cuidado de los pacientes mientras mantienen una seguridad de datos confiable.
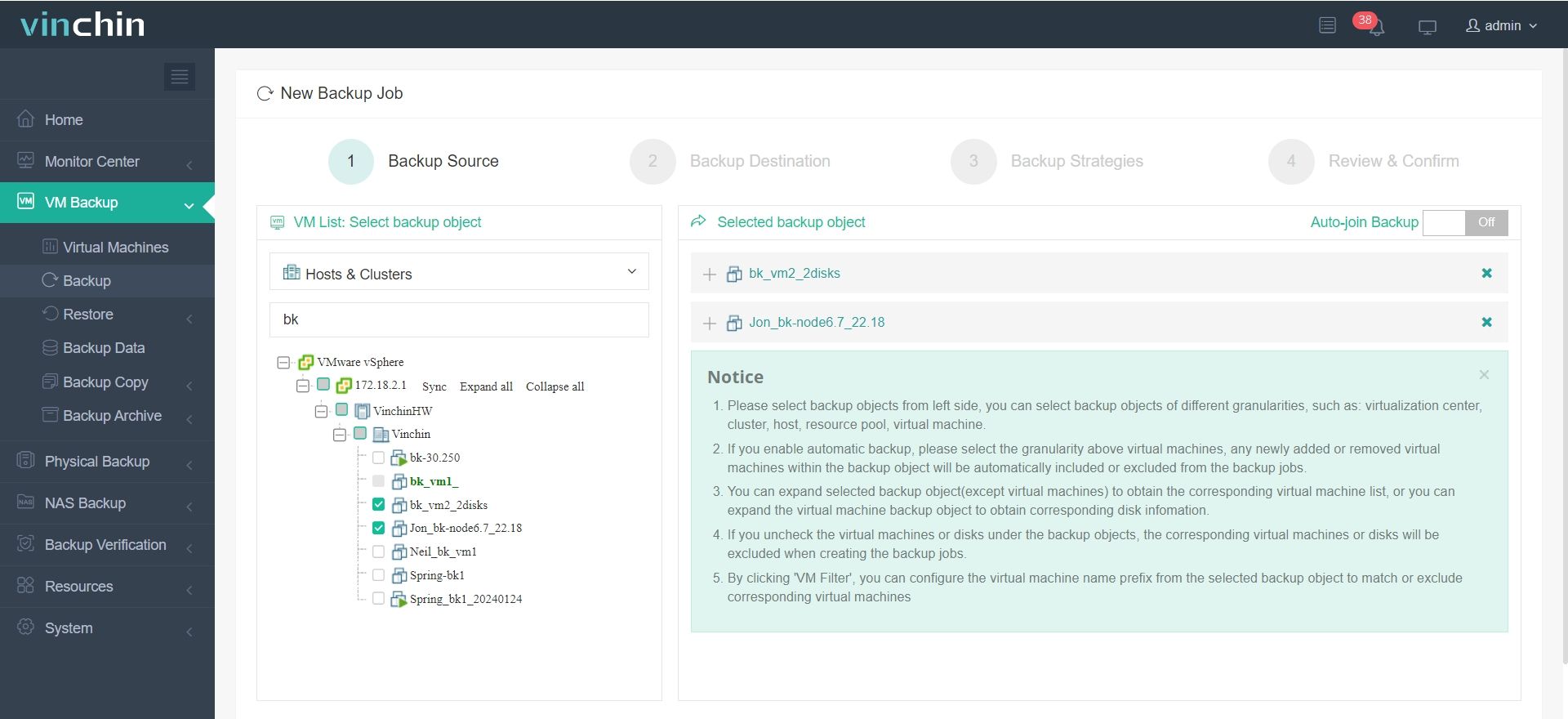
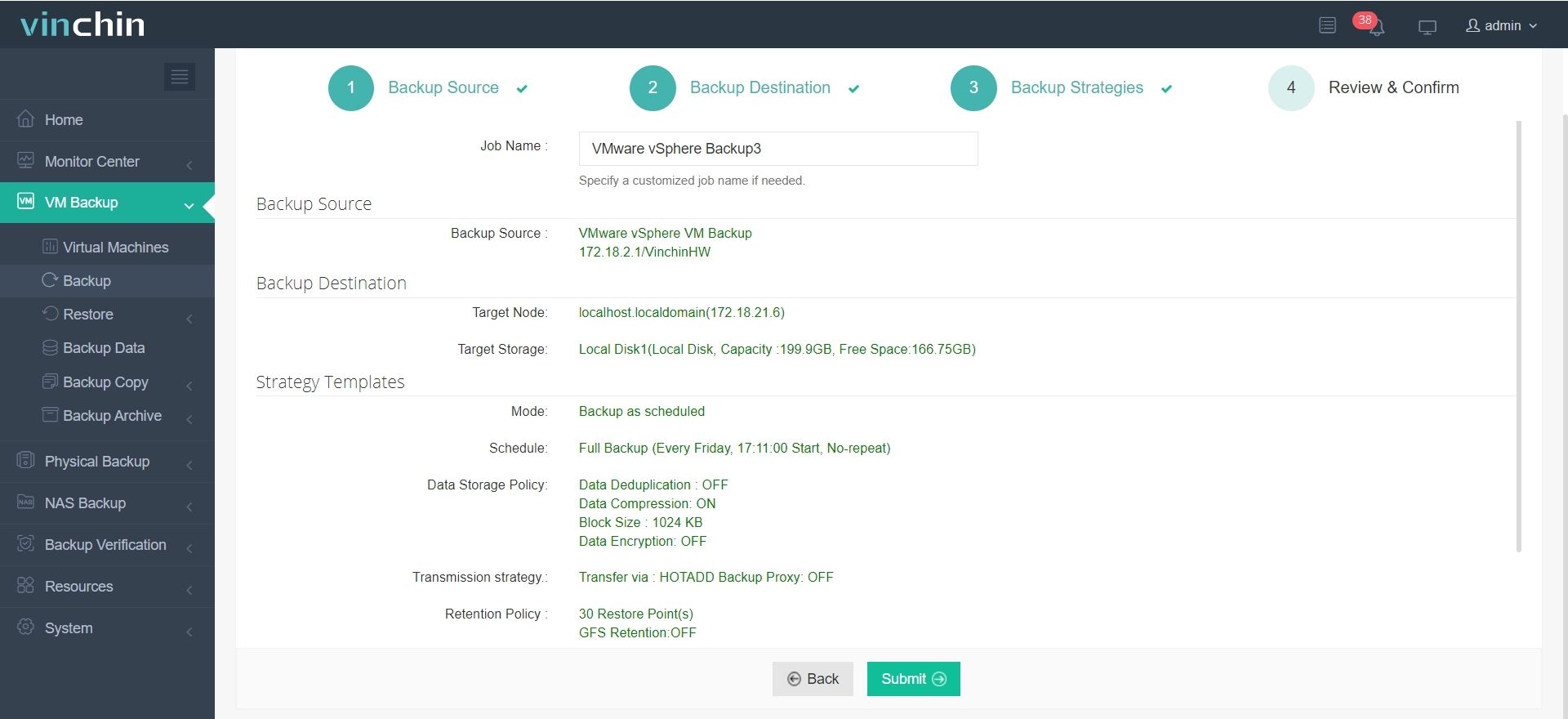
Solo se necesitan 4 pasos para hacer una copia de seguridad de su máquina virtual o base de datos con Vinchin Backup & Recovery:
1. Seleccione el objeto de copia de seguridad.
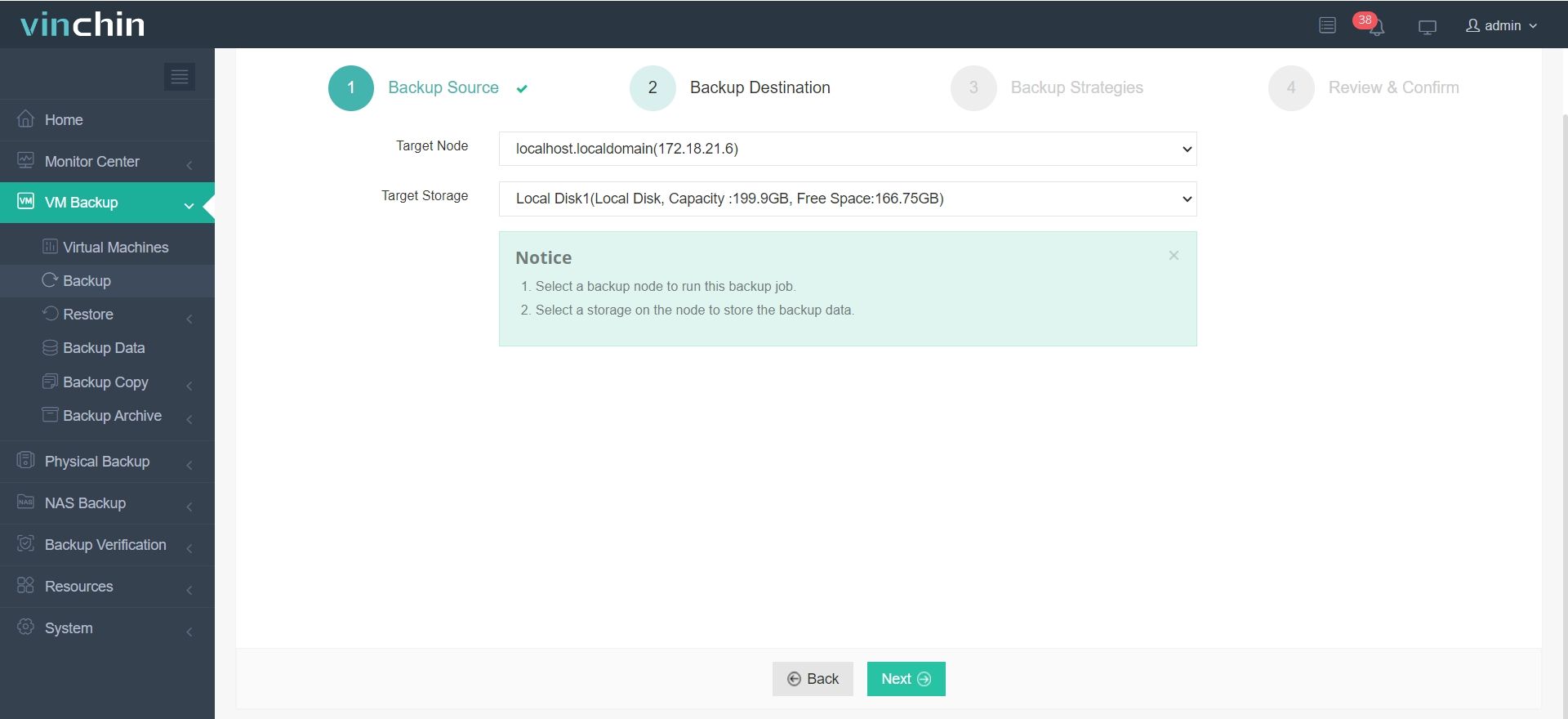
2. Seleccione el destino de la copia de seguridad.
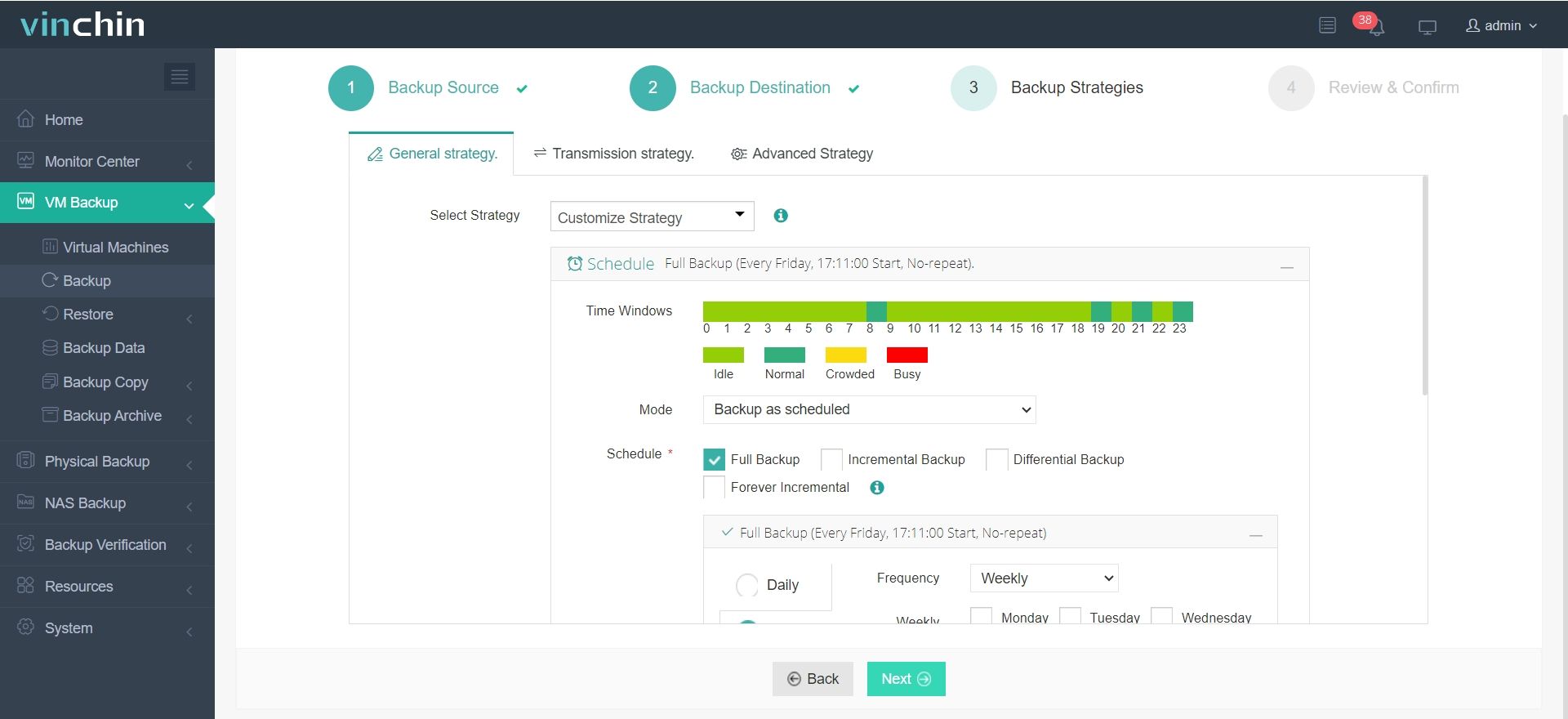
3.Configurar estrategias de copia de seguridad.
4. Revise y envíe el trabajo.
Descubra por sí mismo el poder de este sistema integral con una prueba gratuita de 60 días! Deje sus necesidades específicas, y obtendrá una solución personalizada que se adapta perfectamente a su entorno informático.
Preguntas frecuentes sobre ensayos clínicos del RGPD
1. ¿Cuál es la diferencia entre el GDPR y el RCE?
El GDPR se centra en la protección de datos y la privacidad, mientras que el CTR rige la realización de ensayos clínicos en la UE. Sin embargo, ambas normativas se solapan y es necesario cumplir con ambas.
2. ¿Pueden los participantes retirar su consentimiento para el procesamiento de datos después de que haya comenzado el ensayo?
Sí, los participantes pueden retirar su consentimiento para el procesamiento de datos en cualquier momento. Sin embargo, esto no afecta la legalidad del procesamiento realizado antes de la retirada. Los patrocinadores deben informar a los participantes sobre este derecho durante el proceso de consentimiento.
Conclusión
En los ensayos clínicos, proteger la privacidad de los participantes es un respeto a sus derechos fundamentales y una condición necesaria para cumplir con las leyes y estándares éticos de diversos países. Los investigadores e instituciones deben asegurarse de que toda la recopilación, almacenamiento, uso y divulgación de datos cumplan con la normativa vigente y adoptar medidas efectivas para proteger la información personal y la seguridad de la privacidad de los participantes.
Compartir en: