-
O que é o GDPR?
-
Qual é o papel do GDPR nos ensaios clínicos?
-
Regulamento da União Europeia sobre Ensaios Clínicos
-
A recuperação de desastres na saúde é essencial
-
Perguntas frequentes sobre ensaios clínicos do GDPR
-
Conclusão
Os ensaios clínicos contribuem para a melhoria contínua dos procedimentos de diagnóstico e tratamento e são uma parte indispensável do progresso médico. Ligados de forma estreita aos ensaios clínicos estão os exames e testes laboratoriais realizados nos pacientes. O processo envolve o manuseio de grandes quantidades de dados de saúde e genéticos. É fundamental que os ensaios clínicos estejam em conformidade com as leis de proteção de dados. Desde a implementação do GDPR nos países europeus, os serviços de saúde e fornecedores de tecnologia têm reformulado de forma abrangente seus modelos tradicionais de trabalho, garantindo que seus serviços médicos permaneçam mais interconectados e centrados no paciente.
O que é o GDPR?
O Regulamento Geral sobre a Proteção de Dados (GDPR) é uma regulamentação estabelecida pela União Europeia para proteger a privacidade e os dados pessoais dos indivíduos dentro da UE e do Espaço Econômico Europeu (EEE). Ele foi promulgado em 25 de maio de 2018, com o objetivo de dar aos indivíduos mais controle sobre suas informações pessoais e simplificar o ambiente regulatório para negócios internacionais ao unificar as leis de proteção de dados na Europa. O GDPR estabelece diretrizes rigorosas sobre como as empresas devem coletar, processar, armazenar e transferir dados pessoais.
Segundo o GDPR, as organizações devem obter consentimento explícito dos indivíduos para processar seus dados, garantir o direito de acesso, correção e exclusão dos dados, bem como informar qualquer violação de dados em até 72 horas. O não cumprimento do GDPR pode resultar em multas elevadas, de até 4% do faturamento global anual da empresa ou 20 milhões de euros (o que for maior). O regulamento destaca transparência, responsabilidade e segurança, visando garantir que os direitos à privacidade dos indivíduos sejam respeitados, ao mesmo tempo que permite que as empresas operem em uma economia digital global.
Qual é o papel do GDPR nos ensaios clínicos?
Dados de saúde são considerados dados sensíveis segundo o GDPR. Facilitar a troca de dados de saúde entre os Estados Membros tornou-se cada vez mais importante no setor de saúde pública, com medidas que incluem principalmente a prestação de cuidados médicos ou tratamentos, prevenção de ameaças graves transfronteiriças aos dados de saúde e garantia de altos padrões de cuidados médicos, além da qualidade e segurança dos produtos e dispositivos médicos. O GDPR estabelece regras para assegurar o processamento legal e confiável dos dados de saúde dentro da União Europeia, aplicando-se também a terceiros que obtenham dados médicos dos pacientes, incluindo resumos médicos, receitas eletrônicas e registros eletrônicos de saúde completos e contínuos, bem como ao uso desses dados para fins de pesquisa científica.
A transferência transfronteiriça de dados de ensaios clínicos envolve múltiplos aspectos, tais como leis nacionais, regulamentações e proteção à privacidade. Por exemplo, a transferência transfronteiriça de dados de ensaios clínicos nos Estados Unidos é protegida pela Lei de Responsabilidade e Portabilidade do Seguro Saúde (HIPAA), que tem como objetivo garantir a segurança e privacidade das informações médicas. A HIPAA exige que as informações pessoais de saúde sejam protegidas com medidas de privacidade similares às dos EUA ao serem transferidas para o exterior. Por outro lado, a União Europeia implementou o Regulamento Geral sobre a Proteção de Dados (GDPR), que se aplica à transferência transfronteiriça de dados pessoais, incluindo dados de ensaios clínicos. A maioria dos países fora da UE também exigem que as transferências de dados sejam protegidas em um nível semelhante às proteções internas.
No campo dos ensaios clínicos descentralizados (DCT), o GDPR também desempenha um papel importante. As assinaturas eletrônicas estão sendo cada vez mais utilizadas nos cenários de DCT. Algumas regiões/países exigem verificação da identidade do participante por meio de link de vídeo ao fornecer assinaturas eletrônicas. Dependendo da classificação de risco e nível de intervenção do ensaio clínico, diferentes tipos de assinaturas eletrônicas podem ser exigidos, e todas as formas de consentimento eletrônico/assinaturas eletrônicas devem estar em conformidade com o GDPR. Normalmente, é considerada uma boa prática, e às vezes obrigatório, realizar uma avaliação de impacto à proteção de dados para avaliar os riscos sob a perspectiva da privacidade das informações ao utilizar formulários de consentimento eletrônicos.
Além disso, os dados coletados devem obedecer aos mesmos padrões de GCP que qualquer outro método de coleta de dados. Caso haja alguma preocupação quanto à qualidade dos dados, deve-se considerar uma nova verificação. Além disso, todo o processamento de dados pessoais no âmbito do DCT deve estar em conformidade com o GDPR.
Regulamento da União Europeia sobre Ensaios Clínicos
O Regulamento da União Europeia sobre Ensaios Clínicos (CTR) é uma regulamentação destinada a padronizar e melhorar o processo de realização de ensaios clínicos em toda a UE. Foi introduzido para reforçar a segurança dos pacientes, aumentar a transparência e simplificar o processo de aprovação dos ensaios clínicos, o que é particularmente importante no contexto do panorama rapidamente evolutivo da pesquisa médica. O regulamento entrou em vigor em 31 de janeiro de 2022, substituindo a anterior Diretiva sobre Ensaios Clínicos.
O CTR introduz um sistema centralizado de submissão a nível da UE para pedidos de ensaios clínicos, simplificando o processo de aprovação e reduzindo a carga administrativa para os promotores. Também exige maior transparência, disponibilizando publicamente os resultados dos ensaios clínicos por meio do Registo Europeu de Ensaios Clínicos. O regulamento garante proteções mais rigorosas aos participantes dos ensaios, incluindo processos mais estritos de consentimento informado e uma supervisão mais eficaz do andamento dos ensaios. Além disso, facilita a realização de ensaios multinationais, tornando mais fácil para as empresas conduzirem pesquisas em múltiplos Estados-Membros da UE.
A recuperação de desastres na saúde é essencial
Os ensaios clínicos da indústria de saúde estão avançando em direção à digitalização e descentralização, com um aumento no volume de dados e colaboração global mais profunda. A recuperação de desastres é crucial para os ensaios clínicos, pois garante a segurança dos dados, a continuidade dos testes e o cumprimento das regulamentações. Ela ajuda a prevenir falhas nos testes ou riscos aos pacientes causados por perda de dados ou interrupções nos sistemas.
Vinchin Backup & Recovery foi desenvolvido para atender às necessidades de proteção de dados de organizações de saúde que enfrentam transformação digital. Com suporte a múltiplas plataformas de virtualização, como VMware, Proxmox, XensServer, Oracle, Hyper-V e bases de dados populares, a Vinchin garante alta disponibilidade e cópias de segurança dos dados. Recursos como deduplicação, compactação e integração com a nuvem ajudam a otimizar o armazenamento e melhorar os tempos de recuperação. Além disso, a Vinchin está em conformidade com regulamentações como o GDPR, garantindo a segurança das informações sensíveis e mantendo a continuidade dos negócios em caso de desastres. Isso permite que os prestadores de serviços médicos se concentrem no cuidado ao paciente enquanto mantêm uma segurança confiável dos dados.
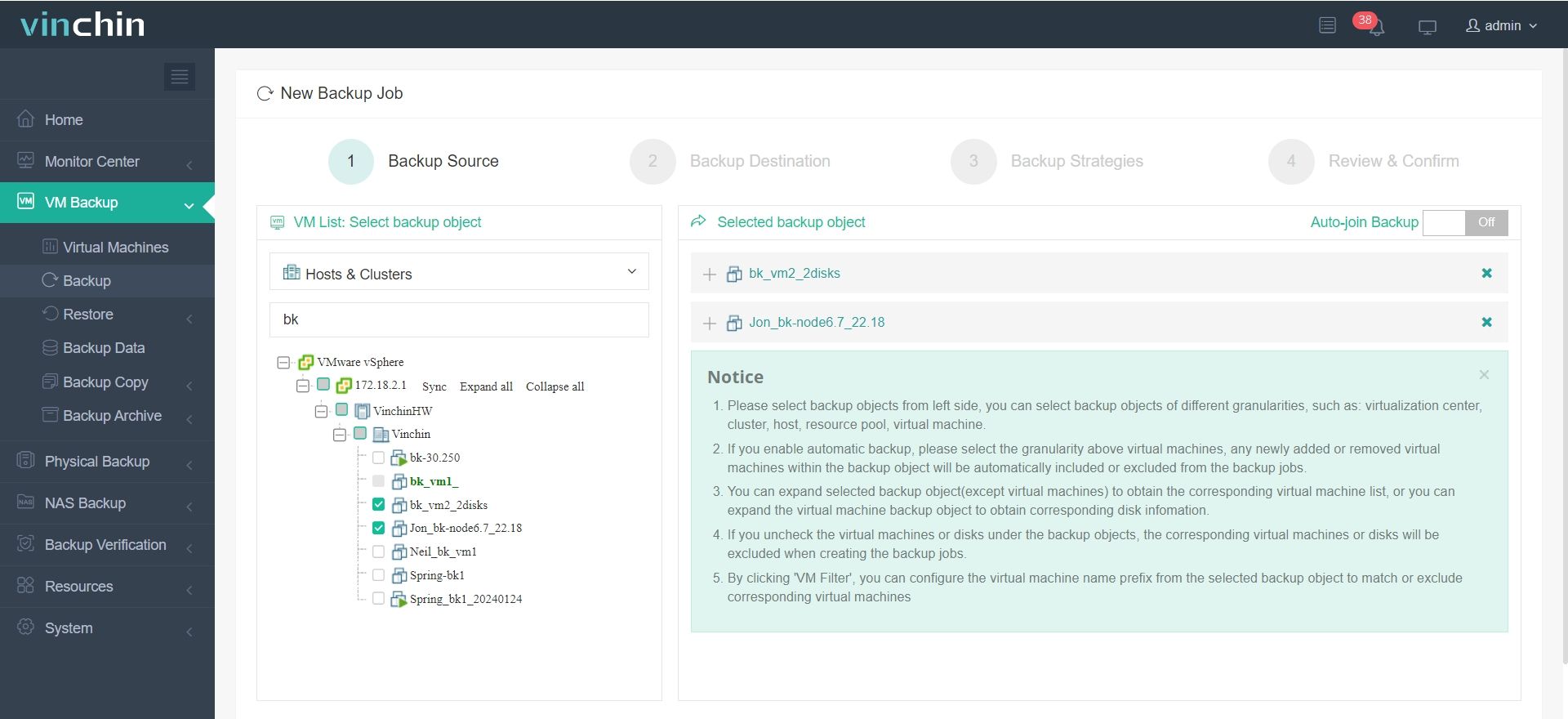
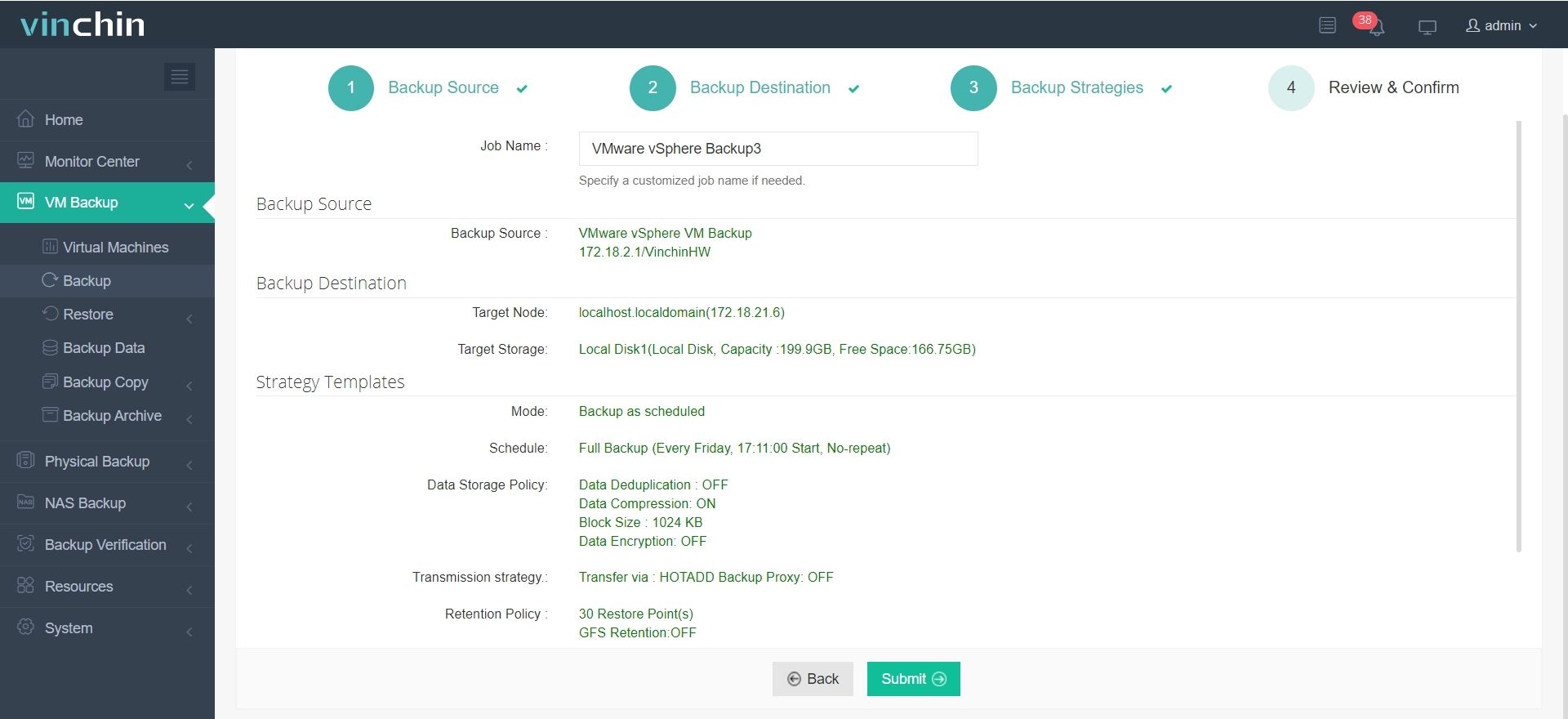
São necessários apenas 4 passos para fazer o backup da sua máquina virtual ou banco de dados com o Vinchin Backup & Recovery:
1.Selecione o objeto de backup.
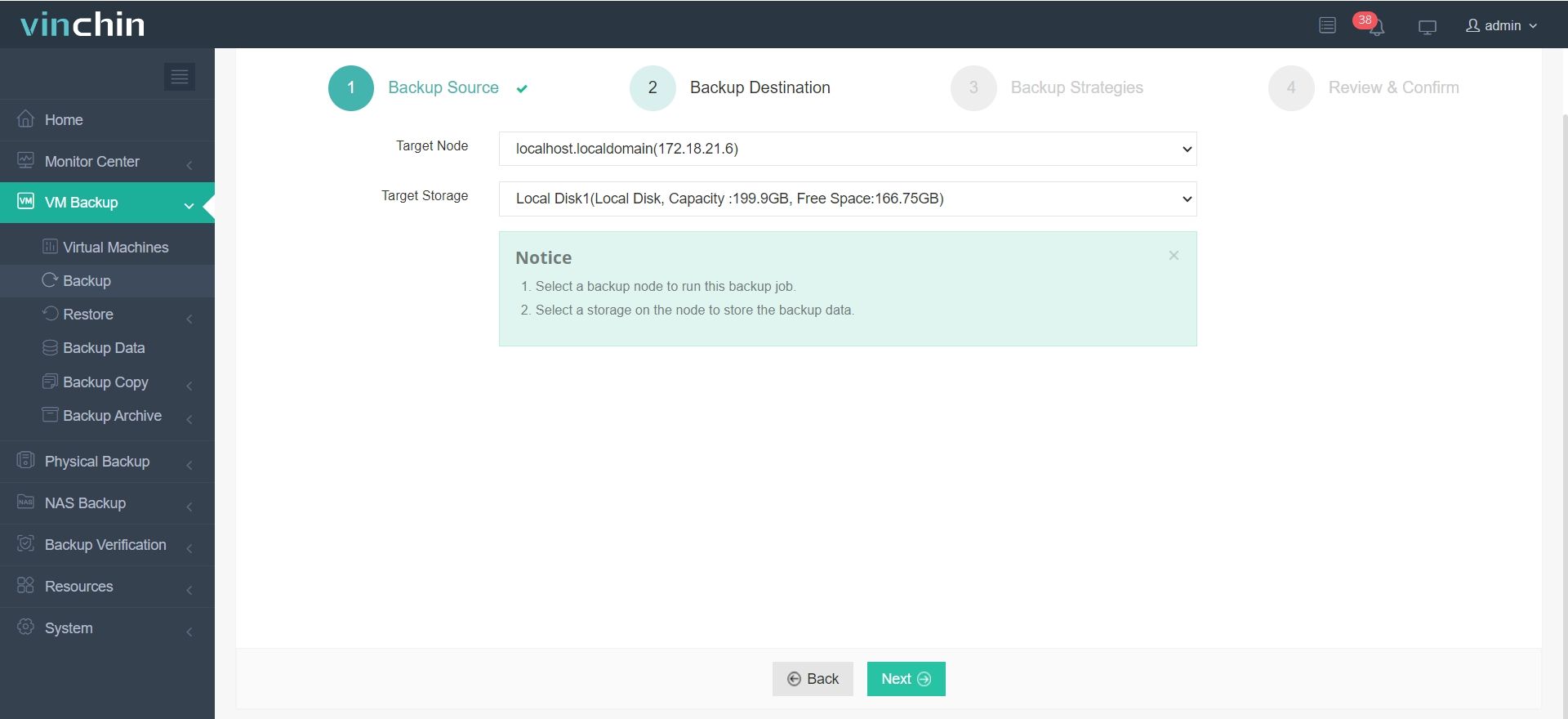
2.Selecione o destino do backup.
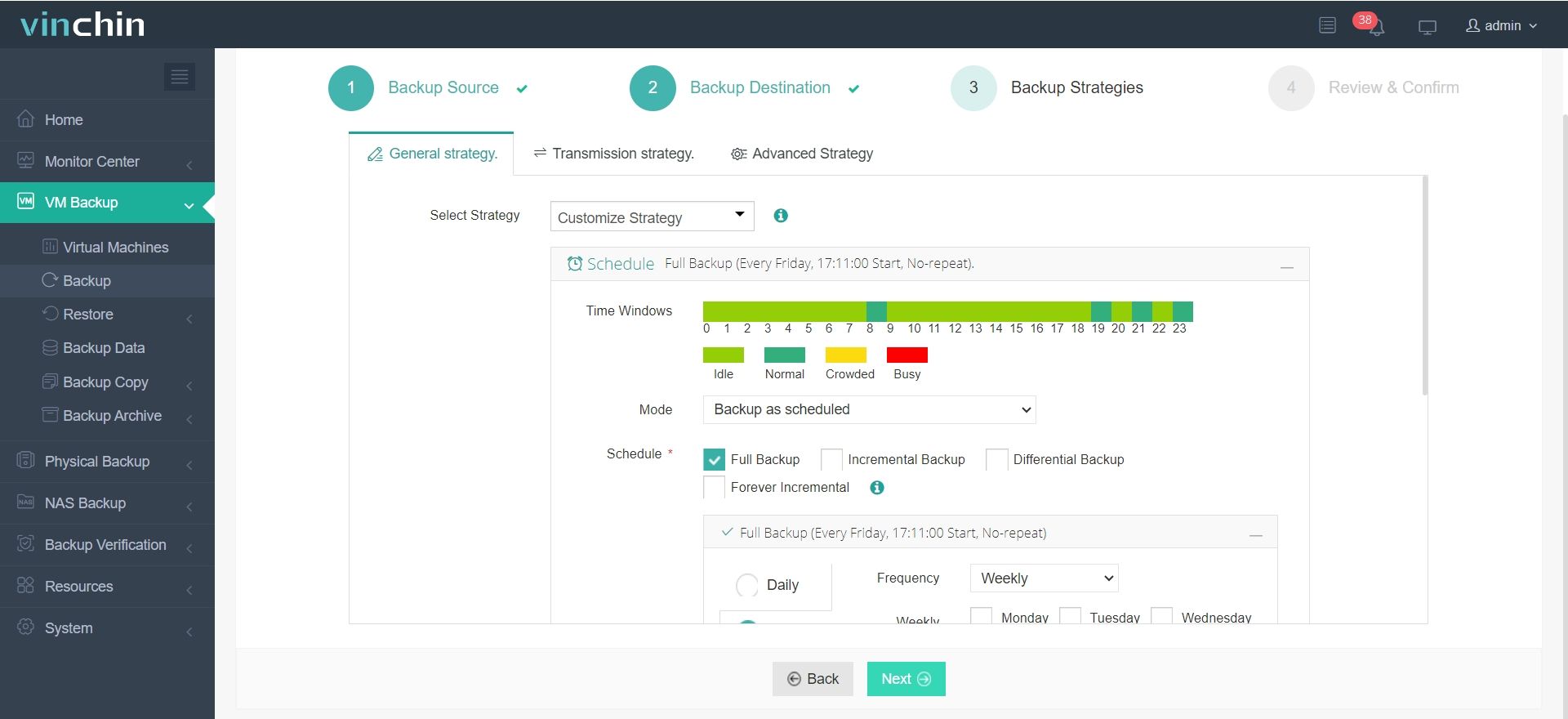
3.Configurar estratégias de backup.
4. Revise e envie o trabalho.
Descubra o poder deste sistema completo em primeira mão com uma avaliação gratuita de 60 dias! Deixe sua necessidade específica, e você receberá uma solução personalizada que se encaixa perfeitamente no seu ambiente de TI.
Perguntas frequentes sobre ensaios clínicos do GDPR
1. Qual é a diferença entre o GDPR e o CTR?
O GDPR se concentra na proteção de dados e privacidade, enquanto o CTR rege a realização de ensaios clínicos na União Europeia. No entanto, as duas regulamentações se sobrepõem, sendo necessária a conformidade com ambas.
2. Os participantes podem retirar o seu consentimento para o tratamento de dados após o início do estudo?
Sim, os participantes podem retirar o consentimento para o processamento de dados a qualquer momento. No entanto, isso não afeta a legalidade do processamento realizado antes da retirada. Os patrocinadores devem informar os participantes sobre este direito durante o processo de consentimento.
Conclusão
Nos ensaios clínicos, proteger a privacidade dos participantes é um respeito aos seus direitos fundamentais e uma condição necessária para o cumprimento das leis e padrões éticos de diversos países. Pesquisadores e instituições devem garantir que toda coleta, armazenamento, uso e compartilhamento de dados estejam em conformidade com as regulamentações legais e adotem medidas eficazes para proteger as informações pessoais e a segurança da privacidade dos participantes.
Compartilhar em: